
Gazlarda hacim ve basınç ilişkisi nedir?
Gazların hacim ve basınç ilişkisi, fiziksel kimya ve mühendislikte kritik bir öneme sahiptir. Boyle, Charles ve Avogadro yasaları, bu ilişkilerin temelini oluşturur. Gerçek gazların davranışını anlamak için ideal gaz yasalarındaki düzeltmeler dikkate alınmalıdır. Bu bilgiler, endüstriyel uygulamalarda ve bilimsel araştırmalarda önemli bir rol oynar.
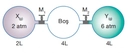
Gazlarda Hacim ve Basınç İlişkisi Gazların hacim ve basınç ilişkisi, fiziksel kimya ve termodinamik alanında önemli bir konudur. Bu ilişki, gazların davranışlarını anlamak için kritik bir rol oynamaktadır. Gazların hacim, basınç, sıcaklık ve moleküler yapı gibi değişkenlerle olan etkileşimleri, çeşitli bilimsel ve mühendislik uygulamalarında dikkate alınmaktadır. Boyle Yasası Boyle yasası, sabit sıcaklık altında bir gazın hacmi ile basıncı arasındaki ters orantıyı tanımlar. Bu yasa, bir gazın hacminin azalması durumunda basıncının arttığını ve hacmin artması durumunda basıncının azaldığını ifade eder. Matematiksel olarak, bu ilişki şu şekilde ifade edilir:
Burada P, basıncı; V, hacmi; 1 ve 2 ise başlangıç ve son durumları temsil eder. Bu yasa, özellikle kapalı sistemlerde gazların davranışını incelemek için kullanışlıdır. Charles Yasası Charles yasası, sabit basınç altında bir gazın hacminin sıcaklıkla orantılı olduğunu belirtir. Bu yasa, gazın sıcaklığı arttıkça hacminin de artacağını ifade eder. Matematiksel olarak ifade edilirse:
Burada V, hacmi; T ise sıcaklığı (Kelvin cinsinden) temsil eder. Bu yasa, gazların sıcaklık değişimlerine nasıl tepki verdiğini anlamak için önemlidir. Avogadro Yasası Avogadro yasası, eşit sıcaklık ve basınç altında, eşit hacimlerin eşit sayıda molekül içerdiğini ifade eder. Bu, gazların doğası hakkında önemli bilgiler sunar ve gazların hacim ve molekül sayısı arasındaki ilişkiyi açıklar. Matematiksel olarak ifade edilirse:
Burada V hacmi, n molekül sayısını ve k sabit bir değeri temsil eder. Bu yasa, gazların mol sayısına dayalı hesaplamalarda kullanılır. İdeal Gaz Yasası İdeal gaz yasası, gazların davranışını tanımlayan temel bir yasadır ve şu şekilde ifade edilir:
Burada P basıncı, V hacmi, n molekül sayısını, R gaz sabitini ve T sıcaklığı temsil eder. Bu yasa, ideal gazlar için geçerli olup, gerçek gazların davranışını belirlemek için bir referans noktası sağlar. Gerçek Gazların Davranışı Gerçek gazlar, ideal gaz yasalarına her zaman uymamaktadır. Gazların yüksek basınç ve düşük sıcaklık koşullarında moleküller arası etkileşimler nedeniyle bu yasaların geçerliliği azalır. Van der Waals denklemi gibi düzeltmeler, gerçek gazların davranışını daha iyi anlamak için kullanılabilir. Sonuç Gazların hacim ve basınç ilişkisi, fiziksel kimya ve mühendislik alanlarında kritik bir öneme sahiptir. Boyle, Charles ve Avogadro yasaları gibi temel ilkeler, gazların davranışını anlamak için temel oluşturur. Gerçek gazların davranışını incelemek için ideal gaz yasasındaki düzeltmeler de dikkate alınmalıdır. Bu ilişkileri anlamak, çeşitli endüstriyel uygulamalar ve bilimsel araştırmalar için vazgeçilmezdir. Ekstra Bilgiler Gazların hacim ve basınç ilişkisi, farklı uygulamalarda önemli sonuçlar doğurabilir. Örneğin, otomotiv mühendisliğinde motorların verimliliğini artırmak için gazların sıkıştırılması ve genişletilmesi süreçleri optimize edilmektedir. Ayrıca, gazların depolanması ve taşınması gibi endüstriyel uygulamalarda da bu ilişkilerin anlaşılması büyük önem taşır. Bu makale, gazların hacim ve basınç ilişkisini ele alarak, temel yasalar ve gerçek gazların davranışları hakkında detaylı bilgiler sunmayı amaçlamaktadır. |
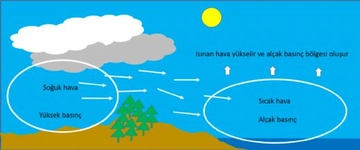
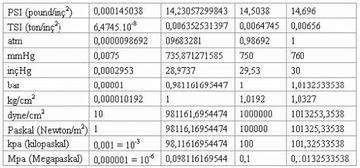
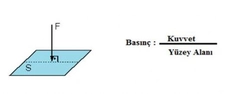

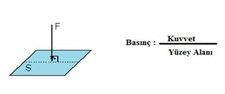

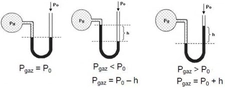





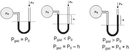











Gazların hacim ve basınç ilişkisi hakkında daha fazla bilgi edinmek istiyorum. Boyle yasası ile hacim azaldıkça basıncın arttığını ve Charles yasası ile sabit basınç altında hacmin sıcaklıkla orantılı olduğunu öğrendim. Peki, bu yasaların gerçek yaşamda nasıl uygulandığını deneyimlediniz mi? Özellikle otomotiv mühendisliğinde gazların sıkıştırılması ve genişletilmesi sürecinin optimizasyonunun önemli olduğu söyleniyor. Bu süreçlerin pratikteki etkilerini ve zorluklarını paylaşabilir misiniz?
Otomotiv mühendisliğinde gazların davranışı gerçekten kritik öneme sahiptir Soysaldı bey. Özellikle içten yanmalı motorlarda Boyle ve Charles yasalarının uygulamalarını şöyle özetleyebilirim:
Motor Tasarımı ve Gaz Sıkıştırma
Pistonların silindir içinde hareketiyle havayakıt karışımı sıkıştırılır - bu Boyle yasasının klasik uygulamasıdır. Hacim azaldıkça basınç artar ve bu da verimli yanma için gereken koşulları sağlar. Modern motorlarda sıkıştırma oranları 8:1 ile 14:1 arasında değişir.
Termal Verim ve Genişleme
Yanma sonrası gazların genişlemesi Charles yasasına uygun davranır. Gazlar ısındıkça genişler ve pistonu iterek mekanik iş üretir. Bu süreçte karşılaşılan en büyük zorluk, genişleme sırasındaki ısı kaybını minimize etmektir.
Pratik Zorluklar
Knocking (vuruntu) problemi sıkıştırma oranı arttıkça ortaya çıkar. Aşırı ısınma, malzeme dayanımı sınırları ve emisyon kontrolü diğer önemli mühendislik zorluklarıdır. Turboşarjer sistemleri de gaz genişlemesinden yararlanarak havayı sıkıştırır ve motor verimliliğini artırır.
Bu prensipler sayesinde modern araç motorları %40'a varan termal verimlilik seviyelerine ulaşabilmektedir.